Des traitements plus coûteux, plus vite autorisés, mais de sérieux doutes sur leur efficacité, leur tolérance et les bénéfices qu’ils apportent réellement aux patients
Volet 1 – Réforme des ATU : anatomie d’une campagne de lobbying
– Premier acte – Le Sénat sort un rapport d’information bien mal inspiré… 13/06/2018
– Deuxième acte – Le Président reçoit à l’Élysée – 09/07/2018
– Troisième acte – Le 8ème CSIS se tient à Matignon sous la Présidence du Premier Ministre – 10/07/2018
– Épilogue du 1er volet: le LEEM, association des firmes pharmaceutiques, se félicite des grandes avancées françaises – 10/07/2018
A suivre:
Volet 2 – Fake innovations de rupture : Le mirage des innovations et les dangers du projet gouvernemental
Volet 3 – Anatomie d’une campagne de presse
Conclusion Générale : Contre-proposition d’une réforme vraiment utile du « système pharmaceutique »
Bibliographie
Introduction
La France se targue, et sa Ministre de la santé, Pre Agnès BUZYN la première, de garantir un accès rapide aux innovations thérapeutiques à tous les patients qui le nécessitent. Car notre pays a mis en place un système d’autorisations temporaires d’utilisation (ATU) unique en Europe. Ce système permet de lancer l’utilisation d’un produit, avant même qu’il ne dispose d’une autorisation de mise sur le marché (AMM), d’une évaluation de sa valeur thérapeutique relative par la Haute Autorité de Santé pour le remboursement, ni même d’un prix négocié entre le Comité Économique des Produits de Santé (CEPS) et les industriels1)
Le 17 octobre, sans véritable débat, l’article 42 du projet de loi de financement de la sécurité sociale (PLFSS) pour 2019 était adopté en commission des affaires sociales, à l’Assemblée nationale. Cet article étend et assouplit encore le régime des ATU.
Cliquer sur l’image ci-dessous pour visionner entre 48:05 et 1:12:58 « l’examen » puis l’adoption de l’article N°42 du PLFSS 2019
 http://videos.assemblee-nationale.fr/video.6758511_5bc741a48c678.commission-des-affaires-sociales–projet-de-loi-de-financement-de-la-securite-sociale-pour-2019-su-17-octobre-2018
http://videos.assemblee-nationale.fr/video.6758511_5bc741a48c678.commission-des-affaires-sociales–projet-de-loi-de-financement-de-la-securite-sociale-pour-2019-su-17-octobre-2018
Dans un premier volet, nous déroulerons une chronologie politique: la demande de déréglementation des ATU est un cas classique de campagne de lobbying.
Dans un second volet, nous étudierons la réalité de cette « innovation de rupture » alléguée : quelles sont les avancées ? Des patients subissent-ils aujourd’hui réellement une perte de chances faute d’accès à de nouveaux produits ? La stratégie culpabilisante redoutable, utilisée pour pousser à la déréglementation, résiste-t-elle à l’examen des données de la science ? Exemples chiffrés et réaction commune de 8 associations de la société civile permettront de mieux décrypter le mythe de l’innovation de rupture.
Enfin, nous étudierons comment cette campagne de lobbying a investi les médias.
Volet 1 – Réforme des ATU: anatomie d’une campagne de lobbying


Premier acte – Le Sénat publie un rapport d’information bien mal inspiré… 13/06/2018
La MECSS (Mission d’évaluation et de contrôle des comptes de la sécurité sociale), une sous-commission de la commission des affaires sociales du Sénat, a publié le 13 juin un rapport d’information intitulé « Accès précoce à l’innovation en matière de produits de santé »2)
La synthèse du rapport frappe par son lyrisme inhabituel pour un rapport sénatorial : « espoirs formidables pour les patients », « traitements les plus prometteurs », « (dispositif des ATU) unanimement plébiscité par les acteurs de la santé », « les patients bénéficient d’un gain de chances considérable ».
Il est tout aussi frappant de constater que le rapport reprend intégralement tant les critiques du dispositif actuel portées habituellement par les firmes pharmaceutiques, que leurs propositions, qui ne visent qu’à rendre ce dispositif encore plus favorable à leurs intérêts. En voici quelques extraits :
« Le cadre des ATU rencontre aujourd’hui ses limites scientifiques : il ne permet pas les extensions d’indication », [Actuellement les extensions d’indication réclament de la part de l’industriel de déposer un nouveau dossier complet, qui doit être examiné par les différentes instances, EMA, ANSM, HAS, CEPS. D’où de nouveaux délais. Les industriels voudraient obtenir une autorisation conditionnelle qui permettrait de mettre le produit immédiatement sur le marché sans réaliser d’études supplémentaires sur le nouvel organe ciblé…]
« En conséquence, le mécanisme ne garantit pas à tous les patients de recevoir le traitement disponible le plus efficace »,
« La complexité de ce mode de calcul remet en cause la lisibilité du système et pourrait éroder son attractivité » (A propos du « remboursement rétroactif de la différence entre l’indemnité fixée par les laboratoires pendant l’ATU » (prix libre pour la firme) « et le prix du médicament fixé après son AMM, qui repose sur la prévision des volumes de ventes pour les trois années suivant la sortie de l’ATU »
« La procédure en vue de l’admission au remboursement (évaluation HAS et négociation prix avec le CEPS) doit durer en théorie 180 jours,… D’après l’EFPIA (Fédération européenne des entreprises pharmaceutiques) le délai moyen entre AMM européenne et commercialisation est passé à 408 jours (2011-2014) et même à 530 jours (2014-2016), ce qui classe la France loin derrière l’Allemagne et le Royaume-Uni »
« La phase d’évaluation par la HAS est rigoureuse mais ses modalités sont réinterrogées : les AMM, délivrées à un stade de plus en plus précoce sur la base de données immatures, conduisent à une forme de « pari ». Pour les industriels, en résulterait parfois un excès de prudence »
A comparer aux 18 propositions faites par les sénateurs, de façon étonnante toutes favorables aux firmes:
Comment un rapport d’information sénatorial peut-il être amené à reprendre à la lettre l’agenda des firmes pharmaceutiques ? Où sont les biais d’influence ?
La réponse est en grande partie à trouver du côté des personnes auditionnées par la mission sénatoriale. A de rares exceptions, toutes sont bénéficiaires de ces propositions favorables aux firmes: salariés, responsables et représentants des laboratoires pharmaceutiques; leaders d’opinion, chercheurs, et institutions, rémunérés ou financés par les mêmes firmes. Le manque de diversité et d’indépendance des personnes auditionnées est frappant et explique sans doute l’unanimisme affiché.
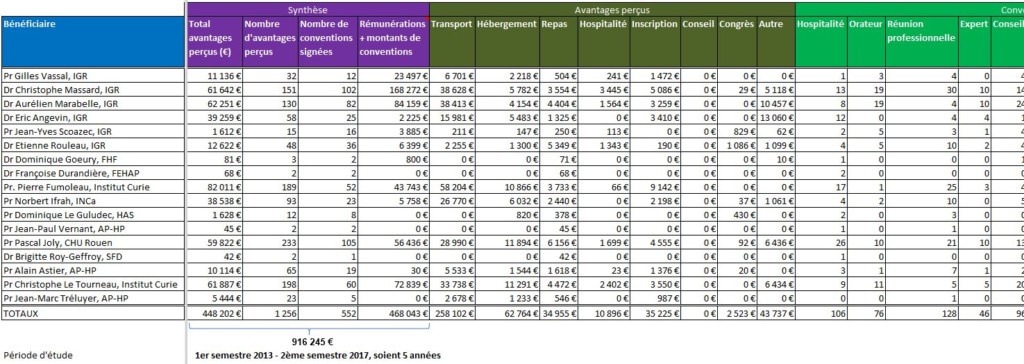
Le tableau ci-dessous synthétise, pour chacun des 17 experts auditionnés concernés par la déclaration des liens dans la base Transparence Santé, les nombres et montants totaux d’avantages perçus, les nombres de conventions signées avec les firmes, et les totaux des montants de conventions et de rémunérations. Il faut souligner que la conception même de la base, fixée par arrêté, fait obstacle à ce travail de synthèse3) :
Cliquer sur l’image ci-dessous pour télécharger le fichier d’analyse détaillée des liens d’intérêts des 17 experts consultés par les sénateurs (A noter que ce type de fichier peut aussi s’ouvrir avec le logiciel libre « Calc » de la suite OpenOffice)
Notons que le Pr. Norbert IFRAH, Président de l’Institut National du Cancer (INCa), n’a plus de liens d’intérêts déclaré dans la base ministérielle depuis sa nomination le 29 juin 2016. Nous savions qu’ils étaient nombreux auparavant, et ceci nous laisse espérer un heureux progrès.
A contrario, l’importance des liens d’intérêts est évidente pour les médecins et responsable des études cliniques de l’Institut Gustave ROUSSY (IGR), ainsi que pour M. le Directeur de l’Institut Curie.
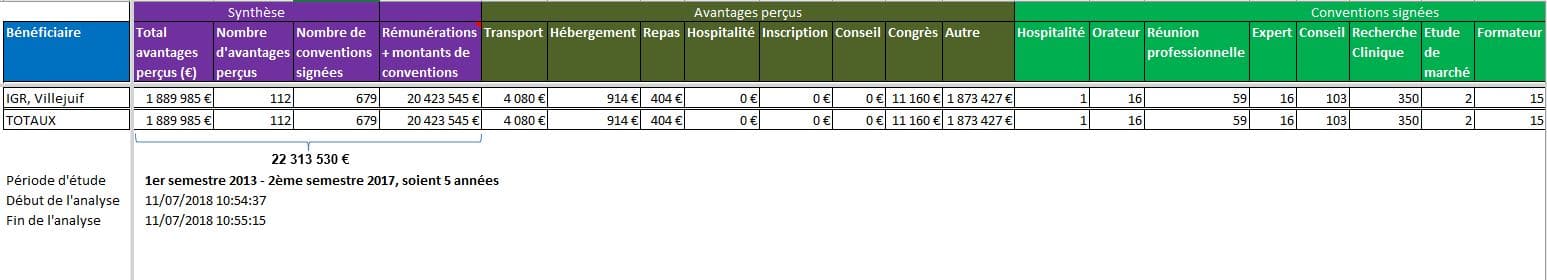
A ces liens personnels de ces experts, il convient d’ajouter les liens qu’entretiennent les institutions dont ils relèvent. Ainsi l’Institut Gustave ROUSSY (IGR) serait bénéficiaire de plus de 22 millions d’euros de rémunérations et dons des firmes:
Cliquer sur l’image ci-dessous pour télécharger le fichier d’analyse des déclarations enregistrées dans Transparence santé
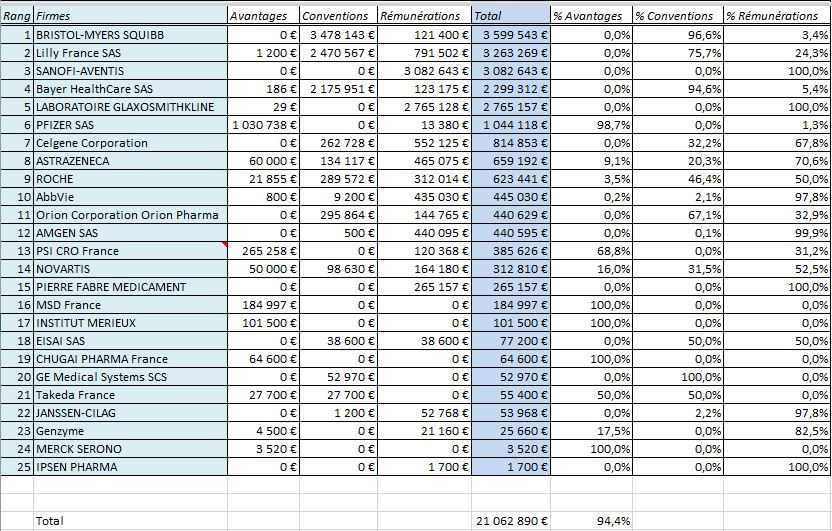
Les 25 firmes ayant déclaré le plus de versements à l’Institut Gustave ROUSSY dans la base Transparence Santé:

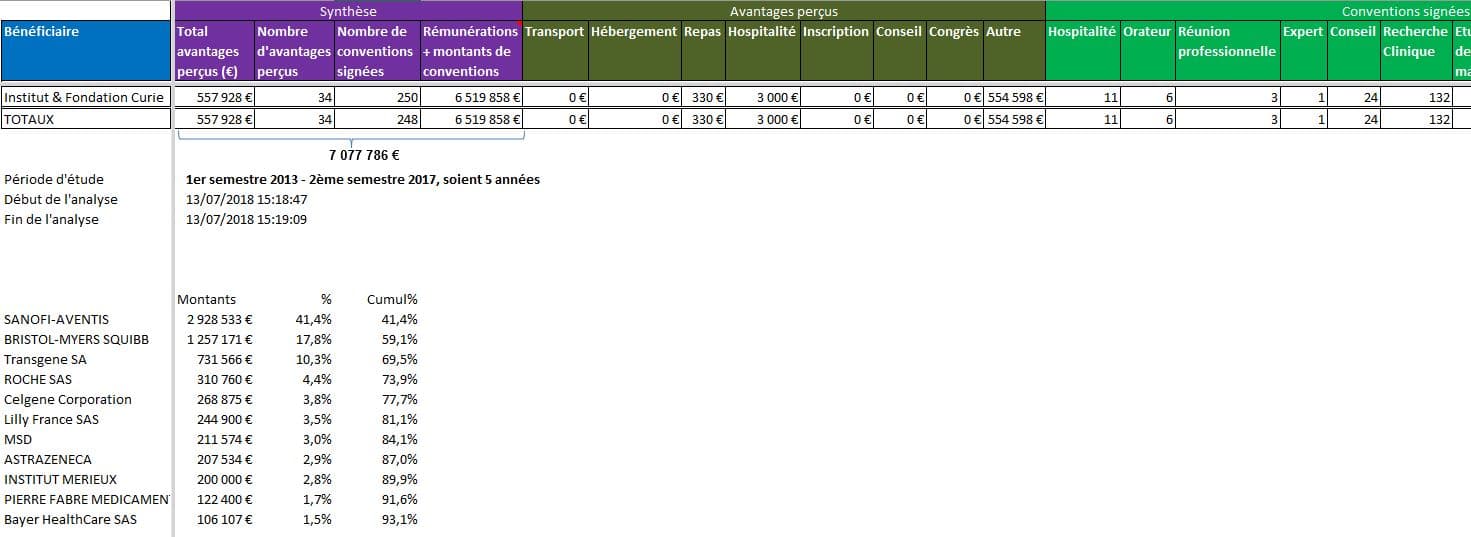
Plus de 7 millions d’euros versés en dons par les firmes à l’Institut Curie, Paris :
Cliquer sur l’image ci-dessous pour télécharger le fichier d’analyse détaillée
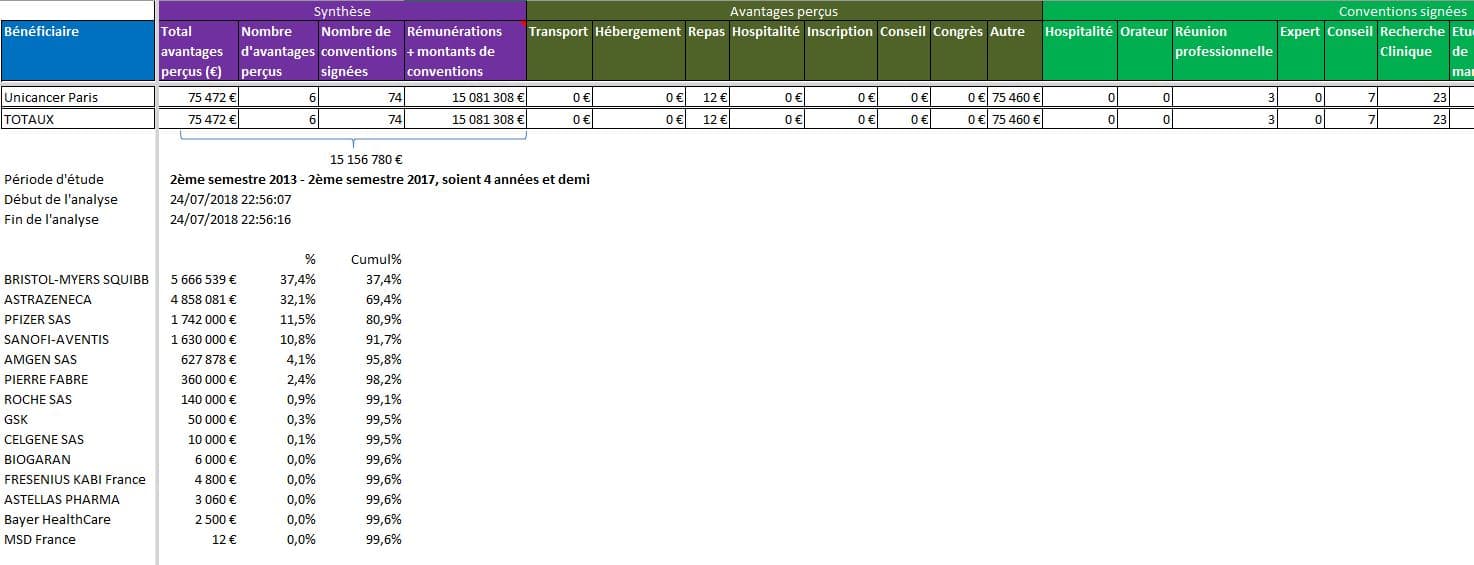
UNICANCER Paris, la Fédération des Centre Régionaux de Lutte Contre le Cancer: plus de 15 millions d’euros de donations:
Cliquer sur l’image ci-dessous pour ouvrir le fichier d’analyse détaillée
Outre ces experts, les sénateurs ont auditionné nombre de dirigeants et lobbyistes des firmes pharmaceutiques concernées4) :

Ont par ailleurs transmis des contributions écrites :
– Roche
– Bristol-Myers Squibb France
– MSD France
Les « contributions écrites » de ces trois firmes, leaders du marché en matière de nouvelles immunothérapies du cancer, n’ont pas été rendues publiques. Ces firmes produisent et commercialisent respectivement TECENTRIQ®, atézolizumab, OPDIVO®, nivolumab, et KEYTRUDA®, pembrolizumab, trois produits ayant bénéficié du régime d’ATU avant d’obtenir une AMM.
Parmi les firmes auditionnées on remarque également:
– L’association AGIPHARM, mentionnée dans la liste précédente, lobby représentant 14 filiales françaises de laboratoires pharmaceutiques américains (voir : ici),
– Nextep, cabinet de conseil en stratégie spécialisé dans la santé. C’est un lobbyiste du secteur (voir : ici). Son site propose en page d’accueil une interview de Mme Catherine DEROCHE, sénatrice et co-auteur du rapport sénatorial : « Les propositions du rapport sur l’accès précoce aux médicaments innovants – notamment sur les ATU – seront dans le PLFSS » : ici,
– Brigitte CALLES, mentionnée à propos du « Collectif » d’entreprises de biotech (un autre lobby de poids) qui a exercé plusieurs années les fonctions de Secrétaire générale du LIR, « Les laboratoires internationaux de recherche », autre lobby influent regroupant 12 filiales de laboratoires internationaux (voir : ici).
Ainsi, les auditions n’ont accordé de place qu’à des experts en position de conflit d’intérêts, lobbies et industriels. En revanche, les avis indépendants de la Revue Prescrire ou de UFC-Que Choisir, n’ont pas été recherchés, malgré leur manifestation d’intérêt. En témoigne leur contribution, que nous aborderons ultérieurement.
La faible représentation des patients est particulièrement flagrante, pour une réforme de l’ATU qui se présente exclusivement comme une demande de leur part et une défense de leurs seuls intérêts. Notamment les patients atteints de cancers, dont les sénateurs ont beaucoup parlé sans jamais leur donner la parole, et qui semblent avoir servi d’alibi à la déréglementation. Seule représentation de patients auditionnée, France Assos Santé a fait entendre une voix critique, qui tranche avec l’unanimisme allégué par le rapport. Cette commission sert-elle les patients ou se sert-elle d’eux ?
Il est surprenant également que les sénateurs n’aient pas pris en considération les préoccupations, toujours d’actualité, d’une précédente mission du Sénat lui-même face aux dérives des ATU et de l’accès rapide à « l’innovation». Dans les suites du scandale du MÉDIATOR®, tout le circuit du médicament avait été audité. A propos des ATU, le rapport sénatorial de l’époque en 2011 demandait à « modifier le statut des ATU, … afin d’éviter que le titulaire des droits d’un médicament n’utilise cette procédure à seule fin de contourner la procédure d’AMM et le mode de fixation du prix 5) ».
Dans le même temps, la commission des affaires sociales de l’Assemblée Nationale, dans son projet de Loi 6) souligne que « l’ancien système donnait, en effet, lieu à un certain nombre de dérives : les ATU étaient parfois utilisées par les laboratoires pour contourner l’autorisation de mise sur le marché, dans des conditions non encadrées et potentiellement dangereuses pour les patients ».
Le maintien des ATU nominatives et de cohorte s’accompagne d’un « contrôle plus serré », qui s’est traduit dans la Loi relative au renforcement de la sécurité sanitaire du médicament et des produits de santé du 29/12/11.
Retour
Deuxième acte – Le Président reçoit à l’Elysée – 09/07/2018
Dans la torpeur de l’été, quelques jours avant la belle victoire de nos footballeurs, Emmanuel MACRON reçoit le 9 juillet 2018 en grandes pompes à l’Elysée les 25 présidents directeurs généraux (PDG/CEO) des plus grandes firmes pharmaceutiques mondiales 7), dont son ami 8)Serge WEINBERG, PDG de SANOFI.
Ces 25 forment le club fermé du Dolder group, qui tenait une de ses réunions juste avant sa réception par l’Elysée. Des engagements ont-ils été pris ? Peu d’informations ont filtré. Dans une interview, Philippe Lamoureux, DG du LEEM, révèle néanmoins un agenda de dérégulation ambitieux de la part du Président Macron. Il précise que les PDG ont été « impressionnés » par l’engagement du Président, qu’il qualifie de « pro-business« , à les réunir à l’Elysée de nouveau dans un an pour mesurer l’avancement de ce programme.
Le calendrier est idéal et constitue un cas d’école de lobbying : le lendemain débute en effet le Conseil Stratégique des Industries de Santé.
Retour
Troisième acte – Le 8ème CSIS se tient à Matignon sous la Présidence du Premier Ministre – 10/07/2018
Le Conseil Stratégique des Industries de Santé est peu connu du public. Selon le communiqué de presse des services du Premier Ministre (ici) : « Créé en 2004, le CSIS est le lieu où s’élabore une vision stratégique du secteur des industries de santé commune aux pouvoirs publics et aux industriels, et où sont proposées des réponses partagées. Le CSIS associe les principaux dirigeants français et internationaux des industries de santé. La poursuite de cette instance de dialogue entre l’Etat et les industries de santé témoigne du caractère stratégique des industries de santé pour la France et de la volonté des pouvoirs publics de s’inscrire dans un dialogue fructueux, dans un contexte de transformation majeure des industries de santé »
Discours d’Édouard PHILIPPE, Premier Ministre, devant un parterre de dirigeants des firmes à Matignon au 8ème CSIS
Cliquer sur l’image ci-dessous pour visionner l’enregistrement vidéo (24 min 37 s)
« Je ne suis pas scientifique, Madame la Ministre de l’enseignement supérieur, de la recherche et de l’innovation me le fait régulièrement remarquer. Je ne suis pas non plus médecin, Madame la Ministre des Solidarités me le fait régulièrement remarquer, non moi je suis plutôt juriste et littéraire… L’objectif fixé par le Président de la République est d’une grande simplicité à formuler. Nous voulons faire de la France le pays le plus attractif et le plus compétitif d’Europe… Ceux qui sont le plus attentifs au débat politique français, savent que je n’ai pas peur de prôner la décélération sur les routes françaises (rires…). Mais, il m’arrive aussi d’inviter à l’accélération. Pas forcément sur les routes, mais quand c’est nécessaire et notamment quand c’est nécessaire pour mettre à la disposition des français les produits dont ils ont besoin et évidemment les produits dont ils ont besoin lorsqu’ils sont malades… »
«…Vous savez que la France se distingue par un dispositif efficace et reconnu, l’ATU. Grâce à elle, les français sont parmi les premiers en Europe à avoir accès aux nouveaux traitements les plus innovants. 500 ATU ont été délivrées depuis le début de l’année. Il nous semble que ce dispositif marche bien, nous allons donc l’améliorer et l’ouvrir aux extensions d’indications dès le projet de loi de financement de la sécurité sociale de cette année. Concrètement, ça veut dire qu’un médicament déjà présent sur le marché qui soigne, par exemple, le cancer du poumon, pourra se voir accorder une autorisation temporaire pour un autre type de cancer. Un plus grand nombre de malades pourra en bénéficier sans attendre et nous étendrons aux dispositifs médicaux une autorisation analogue à l’ATU ».
Le Premier Ministre n’est ni scientifique, ni médecin, il n’est surtout pas raisonnable. La communauté scientifique alerte sur les risques qu’il y a à accélérer les essais cliniques, réduire « drastiquement » l’évaluation du rapport bénéfice / risque et de l’amélioration du service médical rendu des nouveaux médicaments…
Voici les engagements pris lors du CSIS :
Synthèse des principales mesures annoncées p4
Des délais d’accès au marché accélérés pour favoriser l’innovation
- Réduction des délais d’accès au marché à 180 jours.
- Réduction des délais d’autorisation des essais cliniques respectivement à 60 jours au niveau des CPP, 45 jours pour les médicaments et les DM/DMDIV et 110 jours pour les médicaments de thérapie innovante au niveau de l’ANSM.
- Accélération des dispositifs d’accès précoce à l’innovation pour couvrir plus de patients, pour les médicaments comme pour les dispositifs médicaux.
La mobilisation de la recherche française
- Développement du mandataire unique.
- Facilitation des échanges de personnel pour favoriser les liens public-privé.
- Création du « Health Data Hub », une des plus grandes bases de données de santé au monde.
Une industrie tournée vers l’innovation
- Développement d’une filière de médicaments de thérapie innovante.
- Emergence d’un hub mondial des biotechnologies de demain en France.
- Mobilisation de 2 milliards d’euros de financements publics et privés vers l’innovation (fonds Innobio II et fonds de fonds FABS).
Un dialogue plus stable et plus lisible
- Simplification des règles de régulation du marché des médicaments.
- Visibilité : un plancher minimal de croissance annuelle de 3% pour les médicaments innovants et 0,5% du chiffre d’affaire, correspondant à 1% des dépenses remboursées, pour l’ensemble des médicaments sur trois ans.
- Redéfinition des orientations du Comité Économique des Produits de Santé pour donner toute sa place à la négociation conventionnelle.
- Préparation de la réforme de l’évaluation des médicaments.
Retour
Épilogue du 1er volet: le LEEM, association des firmes pharmaceutiques, se félicite des grandes avancées françaises – 10/07/2018
Le jour même, « les entreprises du médicament » (LEEM) publient un communiqué de presse triomphant: « Nouvelle méthode, nouveau cadre, nouvelle feuille de route… Un CSIS de rupture pour restaurer l’attractivité de la France » (ici), accompagné d’un dossier de presse de 43 pages téléchargeable sur le site du Gouvernement (ici) « Notre ambition pour les industries de santé ».
Le DG du LEEM, Philippe Lamoureux, parle d’un CSIS « amazing« …


 http://videos.assemblee-nationale.fr/video.6758511_5bc741a48c678.commission-des-affaires-sociales–projet-de-loi-de-financement-de-la-securite-sociale-pour-2019-su-17-octobre-2018
http://videos.assemblee-nationale.fr/video.6758511_5bc741a48c678.commission-des-affaires-sociales–projet-de-loi-de-financement-de-la-securite-sociale-pour-2019-su-17-octobre-2018